一分子の動きを見る:ターザンモデル
[図79] 最後に、「一分子を見る」というところをお話します。最初にお話しましたように、一本足のモーターを我々は見つけましたね。
それまでは二本足のモーターでしたから、我々がレールの上を歩くようにレールの上を動くと考えられていましたが、さて、一本足で本当に動けるのか。
それを証明しなければいけない。そこで、一本足の分子が実際にレールの上を動けるのかどうかを見ことになりました。
この一本足のモーターをモーター領域だけにして、ここに1個だけ蛍光色素をくっ付けます。これをレールの微小管の上に置いて、ATPを入れます。
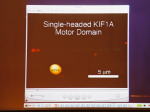
グリーンが1本の微小管で、こちらがプラス端。赤い点が1個のKIF1Aです。一分子のモノマーです。一本足ですね。
これが5μmのバーですが、左側に向かって1μmロン以上動いているのが分かります。
[図80] これをビデオでお見せします。左側に向かって、赤い点が動いているのがお分かりだと思います。
この赤い点は1個のKIF1Aです。左側に向かって動いていますね。こっちがプラス端です。
でも、この動きをよく見ると、スムーズに左側に動いているのではなくて、実は行ったり来たりしながら、トータルとして左側に動いているのですね。
[図81] この動きを解析すると、この動きはブラウン運動をベースにしているということが分かりました。
Biased Brownian-movementです。ブラウン運動で動くのだけれども、それが結果としては一方向に動くようにコントロールされている。
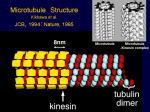
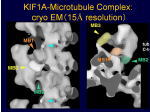
[図82] この動きの機構をいろいろ調べました。微小管の上に一分子のモーター領域をくっ付けて、それをクライオ電子顕微鏡で見ることができます。
[図83] これは15オングスロームですから1.5nmの分解能ですね。モーター分子はこういう形をしているのです。
縦に動いていくのですが、これが1本のレール、プロトフィラメントです。
αβチューブリンが見えて、KIF1Aのモーター領域が三本足のコアラのような格好をしています。
MB1、MB2、MB3という3カ所でレールにくっ付いていて、一本足のモーターの特徴は、このMB3というところにあります。
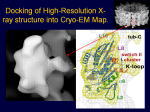
[図84] そのMB3には、私達が「Kループ」と名付けたリシンが6個並んだ配列が、タンパク質の一次構造の中の「ループ12」という部分にあることが分かりました。
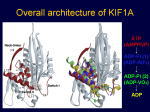
[図85] 詳しい話になりますけれども、そのKループという部分は非常にプラスに荷電している。
これがプロトフィラメントで、これがαβチュブリンで、ここにX線結晶解析で得られたリボンモデルというのを重ね合わせてあります。
これがモーター領域で、KIF1Aの動く部分ですね。強く結合する状態というのは、ATPを加水分解しながら実はプラス端のバイアスをかけているのですが、
そのATPに結合した状態を示しています。これは、MB1、MB2、MB3ですが、原子レベルで、どことどこが相互作用するかいうことが分かっています。
[図86] これがターザンモデル。これがレールの微小管。レールからブランブランと、すごく柔軟性があるチューブリンのC末端が出ています。
これには,グルタメイトが多いので「Eフック」という名前をつけました。蔦ですね。ターザンがつかまる蔦。
これがKIF1Aのモーター分子。KループとEフックが結合し、そしてブラウン運動をするのです。
そこでATPを加水分解することによって、プラス端へのバイアスがかかります。
[図87] どういうふうにバイアスがかかるかということは、このX線結晶解析という方法で分かりました。
ATPを加水分解するいろいろなステップ、この場合には5つの状態の構造を解きました。
AMP-PCP、AMP-PNP、ADP-AlFxというのは、KIF1Aと微小管が強く結合している状態(strong-binding state)。
ADP-Viという状態で、モーター分子がいったんレールから外れるのですね。能動的に(actively detaching state)。
そしてADP状態で弱く結合する(weak-binding state)。これを繰り返してプラス端のほうに動くということが分かりました。
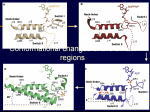
[図88] [図89] このように、スイッチIとスイッチIIの部分で、非常に大きな構造の変化を呈しています。
この過程で、ATPが加水分解され、γ-ホスフェート(γ-phosphate)がヌクレオチド(nucleotide)のバインディングポケット(nucleotide-binding pocket)
というところから放出されるのですね。
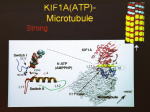
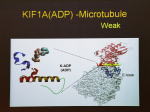
[図90] [図91] それを微小管のレールに当てはめると、モーター分子が強く結合するときには、
ループ11という部分を伸ばして、微小管のレールのほうの H11' というヘリックスを掴みます。
ところが、ATPを加水分解してADP-Viの状態になると、両方の手が外れて能動的にレールから離れます。
一時ですが。次のADP状態で、隣にあるループ12という手を伸ばして、微小管のほうの蔦である柔軟なC末端をつかみ、
ブラブラとブラウン運動をする。これを繰り返して動いている。
[図92] 実は、このようなメカニズムはモーター分子に限らず、ATPやGTPなどのヌクレオチドを加水分解して働くタンパク質、
例えば、Gタンパク質とかタンパク質のリン酸化を行うキナーゼ(kinase)などに共通した性質であるということが分かりました。
つまり、ヌクレオチダーゼ(nucleotidase)がヌクレオチドを加水分解した段階で、モーター分子は一度レールから能動的に離れますが、
Gタンパク質やキナーゼというのも、やはりターゲット分子から外れるのですね。そのために、このヌクレオチドの加水分解の力を使っている。
そして、モーター分子の実際の動きはブラウン運動を使っているということが分かったのですよ。
[図93] 最後に、この一本足のモーターがブラウン運動を使ってどうやって動いていくか。
それをまとめたビデオをお見せします。これがレールのほうです。これがEフックというチュブリンのC末端です。これがモーター領域。
今、KループとEフックがくっ付いた。ADPが放出された後でプラス端のほうにバイアスがかかって動きがでる。
ATPが結合すると、モーターがレールに強く結合する。そして、加水分解が起こって、いったん自発的に解離(dissociation)します。
それから、KループとEフックの結合によってブラウン運動。ブラブラして、ADPを放出した瞬間にプラス端のバイアスがかかる。
そしてATPが結合すると、強く結合する。モーター分子は、こういうふうにブラウン運動を使ってプラス端に向かって動くという、
非常に巧妙な、効果的な、経済的なマシーンであるということが分かってきたわけです。
|
|

[図79]
[図80]

[図81]
[図82]
[図83]
[図84]
[図85]

[図86]

[図87]
[図88]
[図89]
[図90]
[図91]
[図92]

[図93]
|