|
 |
 |
| 細胞の分子1個1個の動きを目で見る |
|
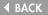 |
|
 |
ミトコンドリアを運ぶモーター分子
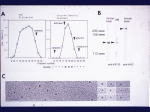
[図25] 次に私たちが見つけたのは、KIF1Bというモーターです。今は、KIF1Bαというふうに名前を変えていますが、このKIF1Bというモーター分子も、
これは電子顕微鏡で見た図ですが、一本足のモーターです。オタマジャクシの尻尾のような、短い尻尾があります。
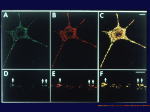
[図26] これは、KIF1Bαの細胞の中での局在を示しています。KIF1Bαの抗体を作って、培養した神経細胞を染めていますが、大きな点状に染まっていますね。
これは、大型の膜小器官にくっついているということを示しています。細胞の中には、ミトコンドリア、リソソーム(lysosome)、分泌顆粒と、
いろいろな膜小器官がありますが、どの膜小器官か。そこで、いろいろなマーカーを使って調べてみました。
この赤いのは、ミトコンドリアのマーカーのミトトラッカーという色素で染めたミトコンドリアの局在を示しています。
緑は、KIF1Bαの局在です。赤と緑が見事に一致して橙になります。つまり、ミトコンドリアにくっ付いているということが示されました。
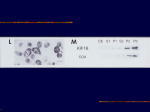
[図27] では、KIF1Bαはミトコンドリアを運んでいるモーターかもしれない。ミトコンドリアというのは、我々の細胞の中のATP、つまり、
エネルギー源を作る工場ですよね。非常に重要な膜小器官。そこで、マウスの脳をすり潰して、ミトコンドリアの多い分画をとってました。
これがそれです。これは、ミトコンドリアのマーカーになるシトクロム・オキシダーゼ(cytochrome oxidase)で、ここにミトコンドリアが多くある。
そこに、まさしく、KIF1Bαも多くあることが分かります。
[図28] それでは、実際に、KIF1Bαでミトコンドリアを微小管のレールの上を動かすことができるかどうかをやってみましょう。
先ず、カバーグラスに微小管のレールを貼り付けます。その上に、ミトコンドリアとKIF1Bα、それとエネルギー源のATPを一緒に入れて垂らします。
そうすると、ミトコンドリアがレールに乗りましたよね。ちゃんとレールの上を動いていきます。
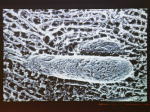
[図29] [図30] この過程をビデオでお見せしましょう。カバーグラスの上に、レールの微小管を動かないように貼り付けます。
この上に、KIF1BαとATPを入れた溶液で、ミトコンドリアを乗せました。少し躊躇していますが、今、動きましたね。レールの上を動いています。
次は、ここに微小管のレール、これがミトコンドリアですが、徐々にスムーズにレールの上を動いていきます。しばらくすると、このレールから外れて、
溶液中を漂ってしまいますね。そして、ブラウン運動をします。
ということで、KIF1Bαがミトコンドリアを運ぶモーター分子だろうということが分かってきました。
そうすると、細胞の中に見えるこの小さい足はKIF1Bαであろうということになるわけです。
モーター分子が無いことが原因の病気
[図31] [図32] 先程、シナプス小胞のKIF1Aのときに、シナプス小胞の材料を運ぶモーター分子はKIF1A以外にもあるだろうというお話をしました。
これは非常に重要なことですから、それを探したわけですが、ごく最近、私たちはそれを見つけました。KIF1Bβという名前を付けました。
これは、実を言うと、先程のミトコンドリアを運ぶKIF1Bαと同じ遺伝子からできる違うタンパク質なのですね。
モーター領域は同じなのですが、尻尾の部分が違うのですね。これはメッセンジャーRNAの選択的スプライシング(alternative splicing)
という機構でできる違うタンパク質なのですけれども、モーター分子というのはモーター領域で動いて、尻尾の部分で運ぶべきカーゴに結合します。
ですから、尻尾の部分が違うということは、カーゴが違うということを予想させるわけです。
詳しくは説明しませんが、生化学的な方法、あるいは電子顕微鏡を用いた方法で見たところ、KIF1Bβの貨物はシナプス小胞の材料だということが、
先ず分かりました。
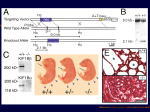
[図33] そこで、我々の体の中での働きを調べるために、KIF1Bβを作れないノックアウトマウスを作りました。この "-/-" というのがそれです。
生まれますが、今度はすぐ死んでしまいます。呼吸ができないのですね。これが肺です。野生型の肺は肺胞が開いていますが、
このミュータントは呼吸ができなくて肺胞が開かない。でも肺の組織は全く正常です。それから呼吸をするために必要な筋肉、呼吸筋も正常です。
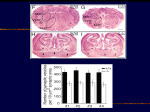
[図34] どうして呼吸ができないのか。中枢神経に原因があるだろうと考えて、脳を調べました。Fが野生型、Gがミュータントです。
KIF1Bβの無いミュータントでは、神経細胞の数が著明に減少している。25%になってしまうのですね。呼吸中枢の神経細胞の数も25%。
呼吸中枢というのは呼吸のセンターで、命令を下すところ。その神経の数が25%になってしまうから呼吸ができない。シナプス小胞の密度も50?60%に減りました。
ここまでは、シナプス小胞の材料を運ぶ新しいモーター分子を見つけたということにしか過ぎないのですが、実は、非常に興味深いことが分かりました。
全くKIF1Bβを作ることのできない個体はすぐ死んでしまうのですけれども、"+/-" のKIF1Bβを50%つくることのできる個体は生きているのです。
ヘテロの個体のときですね。それを飼って1年ぐらいすると、筋力の低下と歩行障害がでて、ヒトの病気とそっくりの症状を示してきたのです。
[図37] そこで、50%しかKIF1Bβを作ることのできない個体を調べました。先ず、歩かせてみます。これが野生型、普通のマウスです。
もちろん普通に元気に歩きまわりますね。今度は、KIF1Bβが50%しかできない個体を見てみると、このように、歩行障害がありますね。
体重を支えきれない。筋力が低下している。これは神経疾患の患者さんの症状にそっくりです。次に、フィックスバーテスト(Fixed-Bar Test)という、
棒の上を歩かせるテストをやります。野生型は器用に歩いていきますね。次に、50%しかKIF1Bβを作ることのできないマウスを棒の上に乗せると、歩けない。
すぐ落ちてしまう。もう1回やります。かわいそうに、震えていますね。すぐに落ちてしまう。今度は、ロータロッドテスト(Rota-Rod Test)といって、
回転する棒の上に乗せます。2ヶ月の野生型、2ヶ月のヘテロ、1年の野生型、1年のヘテロと4匹あります。
この1年のヘテロ、50%しかKIF1Bβを作ることのできない個体が、最も早く棒から落ちてしまう。運動障害と筋力の低下を呈する、ヒトの病気に非常に似た症状です。
それでは、我々の病気との関係を調べてみましょう。KIF1Bβの遺伝子が、マウスのどの遺伝子座にあるかを調べると、4のEというところにありました。
それとオーバーラップするようなヒトの疾患の遺伝子群を調べてみると、シャルコー・マリー・トゥース(Charcot-Marie-Tooth)病という、
3人の発見者の名前がついた病気がありますが、この病気の2A型に対応する原因遺伝子が、ちょうどそのあたりにあるらしいということが分かっていました。
そこで、その病気の家系を調べて、患者さんの血液を調べさせて頂いたところ、KIF1Bβのミューテーションが起こっていた。
モーター領域のATPに結合するアミノ酸の共通配列のところに点突然変異があり、グルタミンというアミノ酸のはずが、
ロイシンになっているということが分かりました。
そこで、そのQLミュータントというKIF1Bβをつくると、ATP活性がほとんどない。つまり、動けないのです。微小管の上を動けない。
繊維芽細胞の中に正常のKIF1Bβを入れると、微小管のレールの上を動けますから、皆このように周りに集まってきます。
ところが、ミュータントのKIF1Bβは動けないので、細胞の真ん中に溜まったままなのです。ということで、KIF1Bβというのが、
シャルコー・マリー・トゥース病2A型の原因になっているということが分かった。つまり、シナプス小胞の材料を運べないので、
こういう病気になってしまうということが分かってきたわけです。そして、モーター分子が病気の原因になっているということも分かってきた。
|
|
[図25]
[図26]
[図27]

[図28]

[図29]
[図30]

[図31]
[図32]
[図33]
[図34]

[図37]
|
|
 |
|
 |
|